电极厚度对锂电池电化学性能的影响!
2023-01-31
来源:电池技术TOP+
本文在电池层面和电极层面上对不同厚度的NMC电极的电化学性能进行了研究,基于实验结果和仿真结果做了一系列的分析,通过电化学模型中电解质盐浓度、活性粒子表面锂离子浓度、电解液电势和过电势这几个关键参数深入地分析了锂离子电池的电极厚度对其电化学性能的影响。
1 实验
为了获得不同厚度的电极,将NCM111正极材料、super-P和溶于NMP溶剂的PVDF粘结剂按照质量比0.85∶0.07∶0.08称量混合后,以300r/min高速球磨3h形成均匀的浆料。在自动涂敷机上采用不同厚度的刮刀将浆料涂覆到铝箔集流体上。在80℃下烘干后,冲压成直径12mm的电极片,再在80℃下真空烘干。制备的NMC电极的参数如表1所示。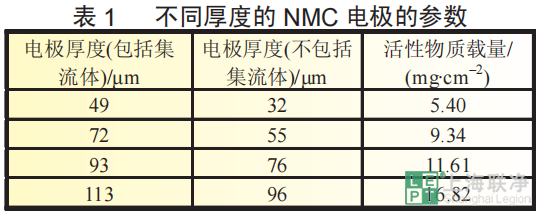 全电池采用2032扣式电池组装。Celgard2400为隔膜,1 mol/L的LiPF6/(EC+DMC) (质量比为1∶1)为电解液,并充分浸润隔膜和电极。制备了一系列不同厚度的石墨负极与NMC电极匹配,石墨负极中包含质量分数为88.8%的石墨、3.2%的super-P和8%的PVDF粘结剂。为了避免负极上的锂沉积,负极与正极的可逆容量的比例控制在1.1~1.2。考虑到石墨工作电压平台的对锂电位为0.1V,NCM111/石墨电池的充放电区间为2.9~4.2V。所有测试都是在25℃室温下通过蓝电充放电设备完成。电池首先以0.05C循环充放电3次,确保组装完好。不同电极厚度的全电池的循环性能是在1C下进行100次充放电测试得出。为了研究电化学参数在电极层面的变化,建立了正极厚度分别为30和100um的 NCM111/石墨电池(命名为电池1和电池2)的一维等温电化学模型。所的仿真结果都采用有限元求解器COMSOL Multiphysics 4.4获得。为了验证模型的有效性,对两个电池测试的放电曲线与仿真结果进行了比较。模型中用到的参数是通过实验测量、文献和估计得到。锂离子电池一维电化学模型的示意图如图1所示,通常由正极集流体(铝箔)、正极活性材料、隔膜、负极活性材料、负极集流体 (铜箔)5个部分组成。电极区域由活性插层材料粒子、电解液、粘结剂和导电剂混合构成,隔膜区域由高分子聚合物和电解液组成。考虑到电池中集流体的两侧都有电化学反应发生,一维电化学模型中集流体的厚度取实际集流体厚度的一半。
全电池采用2032扣式电池组装。Celgard2400为隔膜,1 mol/L的LiPF6/(EC+DMC) (质量比为1∶1)为电解液,并充分浸润隔膜和电极。制备了一系列不同厚度的石墨负极与NMC电极匹配,石墨负极中包含质量分数为88.8%的石墨、3.2%的super-P和8%的PVDF粘结剂。为了避免负极上的锂沉积,负极与正极的可逆容量的比例控制在1.1~1.2。考虑到石墨工作电压平台的对锂电位为0.1V,NCM111/石墨电池的充放电区间为2.9~4.2V。所有测试都是在25℃室温下通过蓝电充放电设备完成。电池首先以0.05C循环充放电3次,确保组装完好。不同电极厚度的全电池的循环性能是在1C下进行100次充放电测试得出。为了研究电化学参数在电极层面的变化,建立了正极厚度分别为30和100um的 NCM111/石墨电池(命名为电池1和电池2)的一维等温电化学模型。所的仿真结果都采用有限元求解器COMSOL Multiphysics 4.4获得。为了验证模型的有效性,对两个电池测试的放电曲线与仿真结果进行了比较。模型中用到的参数是通过实验测量、文献和估计得到。锂离子电池一维电化学模型的示意图如图1所示,通常由正极集流体(铝箔)、正极活性材料、隔膜、负极活性材料、负极集流体 (铜箔)5个部分组成。电极区域由活性插层材料粒子、电解液、粘结剂和导电剂混合构成,隔膜区域由高分子聚合物和电解液组成。考虑到电池中集流体的两侧都有电化学反应发生,一维电化学模型中集流体的厚度取实际集流体厚度的一半。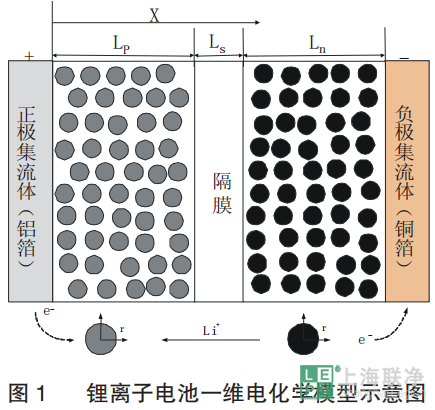 在放电过程,负极活性粒子中的锂离子由内部向表面扩散,在表面与电解液界面处发生电化学反应。锂离子由负极向正极方向的扩散与迁移,在正极发生电化学反应并嵌入活性粒子中。同时,负极电化学反应释放出的电子通过外电路由负极区域到达正极区域,形成放电电流。电池1和电池2电化学模型中的参数如表2所示。电解液电导率、正极和负极的开路电势的方程如下:
在放电过程,负极活性粒子中的锂离子由内部向表面扩散,在表面与电解液界面处发生电化学反应。锂离子由负极向正极方向的扩散与迁移,在正极发生电化学反应并嵌入活性粒子中。同时,负极电化学反应释放出的电子通过外电路由负极区域到达正极区域,形成放电电流。电池1和电池2电化学模型中的参数如表2所示。电解液电导率、正极和负极的开路电势的方程如下: 从电化学的角度来看,锂离子电池通常在在高倍率下放电时的性能会变差。为了探究电极厚度这一因素对锂离子电池性能的影响,对活性物质载量不同的NCM111/石墨电池进行了倍率性能测试。图2显示了不同活性物质载量的电池的放电比容量,电池以不同倍率放电,最后30圈是以1C放电,而每一次充电都是1C。
从电化学的角度来看,锂离子电池通常在在高倍率下放电时的性能会变差。为了探究电极厚度这一因素对锂离子电池性能的影响,对活性物质载量不同的NCM111/石墨电池进行了倍率性能测试。图2显示了不同活性物质载量的电池的放电比容量,电池以不同倍率放电,最后30圈是以1C放电,而每一次充电都是1C。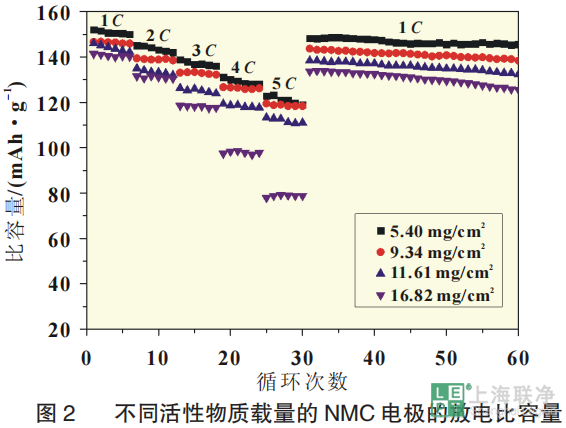 在1C下,最厚的电极(16.82mg/cm2)第1圈放电比容量为141mAh/g。相同条件下,不同厚度的电极的比容量在141~152mAh/g 范围内变化,最薄的电极(5.40mg/cm2)的比容量达到152mAh/g。值得一提的是,在第1圈后的充/放电效率几乎都是99%,这表明充/放电过程的良好的可逆性。而且,低活性物质载量的电极在高倍率下放电容量损失更小。正极活性物质载量为5.40mg/cm2的电池在5C下放电比容量为123mAh/g,相当于1C下放电比容量的81%,而相同条件下电极最厚的电池的容量损失高达44%。对不同电极厚度的NCM111/石墨电池也进行了循环性能测试。以0.05C充放电3圈进行活化后,以1C进行放电和充电测试。不同活性物质载量的电极随着循环次数的增加,电池容量衰退如图3所示。尽管是相同的正极材料与负极材料,不同电极厚度的全电池的循环性能仍显示出明显的差异。100圈循环后,正极最薄(5.40mg/cm2)的电池的容量保持率为88.8%,而正极最厚(16.82mg/cm2)的电池的容量损失率为25.1%。总而言之,电极较厚的电池的容量衰退率较高。
在1C下,最厚的电极(16.82mg/cm2)第1圈放电比容量为141mAh/g。相同条件下,不同厚度的电极的比容量在141~152mAh/g 范围内变化,最薄的电极(5.40mg/cm2)的比容量达到152mAh/g。值得一提的是,在第1圈后的充/放电效率几乎都是99%,这表明充/放电过程的良好的可逆性。而且,低活性物质载量的电极在高倍率下放电容量损失更小。正极活性物质载量为5.40mg/cm2的电池在5C下放电比容量为123mAh/g,相当于1C下放电比容量的81%,而相同条件下电极最厚的电池的容量损失高达44%。对不同电极厚度的NCM111/石墨电池也进行了循环性能测试。以0.05C充放电3圈进行活化后,以1C进行放电和充电测试。不同活性物质载量的电极随着循环次数的增加,电池容量衰退如图3所示。尽管是相同的正极材料与负极材料,不同电极厚度的全电池的循环性能仍显示出明显的差异。100圈循环后,正极最薄(5.40mg/cm2)的电池的容量保持率为88.8%,而正极最厚(16.82mg/cm2)的电池的容量损失率为25.1%。总而言之,电极较厚的电池的容量衰退率较高。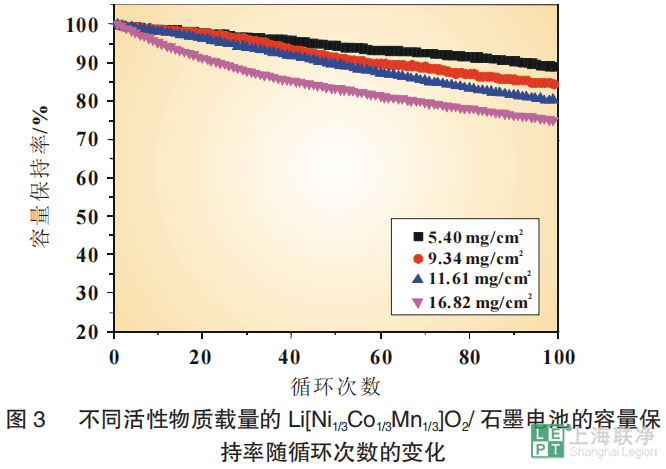 为了评估电化学模型仿真电池放电过程的能力,验证模型的有效性,将仿真结果与 NCM111/石墨电池的实验结果进行了对比。图4(a)、图5(a)分别是正极活性物质载量为5.4和 16.82 mg/cm2 的全电池在1C、2C、3C下放电曲线的比较。
为了评估电化学模型仿真电池放电过程的能力,验证模型的有效性,将仿真结果与 NCM111/石墨电池的实验结果进行了对比。图4(a)、图5(a)分别是正极活性物质载量为5.4和 16.82 mg/cm2 的全电池在1C、2C、3C下放电曲线的比较。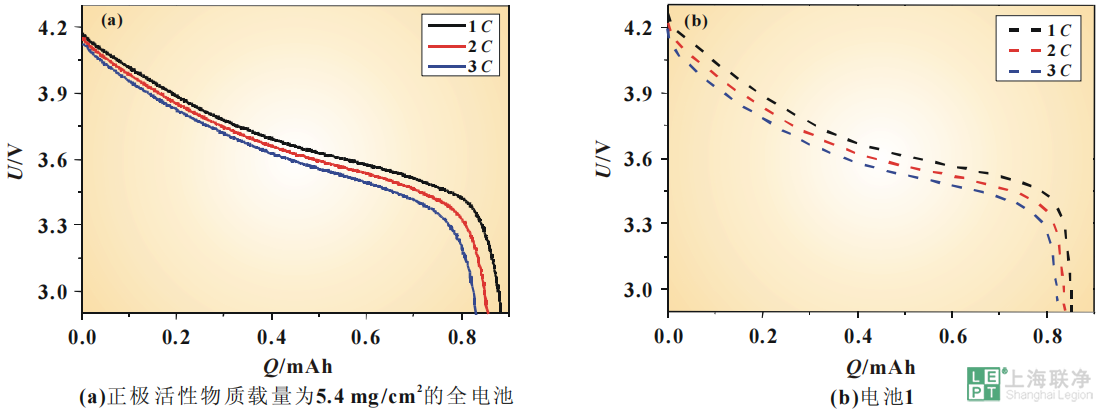 图 4 电极较薄的NCM111/石墨电池实验和仿真的放电曲线电极参数如表1所示。实验过程中,所有电池都被置于25℃室温中。因为要对电池不同倍率放电的曲线进行比较,所以需要从同一初始状态开始放电。先以0.5C恒流充电到充电截止电压,再恒压充电到电流小于0.01C,认为此时的荷电状态(SOC)为100%。实验数据是取自5圈循环后的数据,因为这时电池的容量比较稳定。为了确保实验结果的准确性与可重复性,所有的实验结果取自3次重复测试的平均值。同时对电池1和电池2进行了1C 、2 C、3C放电的仿真。1C分别对应的是7.7和24.5A/m2的电流密度。其参数如表2所示。图4对正极活性物质载量为5.4mg/cm2的全电池1C、2C、3C测得的放电曲线与电池1的仿真放电曲线进行了比较。从图4(a)中可以看到,随着放电倍率的增加,电池会更快达到放电截止电压。正极活性物质载量为5.4mg/cm2的电池的3C放电容量只有其1C放电容量的94%。由于极化内阻的增加,3C放电的起始电位比1C放电的起始电位低了0.05V。而从图4(b)中可以看到,随着放电倍率的增加,仿真曲线也会更快达到放电截止电压,与实验测得的结果是类似的。对电池1而言,1C的放电容量有0.852mAh,与测得的放电容量0.884mAh极为接近。3C放电的容量相当于1C放电容量的97%,高于实际测得的结果,这可能是由于高倍率放电时极化被低估所引起的。正极活性物质载量为16.82 mg/cm2的全电池测得1C、2C、3C的放电曲线与电池2的仿真放电曲线的比较如图5所示。从图5(a)中可以看到,实验测得的3C放电的容量只有其1C放电容量的87%。除此之外,3C放电的起始电位比1C放电的起始电位低了0.09V。与正极活性物质载量为5.4mg/cm2的电池相比,随着电极厚度的增大,极化所引起的电势的下降更加明显。而对于电池2而言,1C的放电容量有2.53mAh,与测得的放电容量2.58mAh也相当接近。而且随着放电倍率的增大,仿真曲线会更快地达到放电截止电压,与实验测得的结果也是相吻合的。
图 4 电极较薄的NCM111/石墨电池实验和仿真的放电曲线电极参数如表1所示。实验过程中,所有电池都被置于25℃室温中。因为要对电池不同倍率放电的曲线进行比较,所以需要从同一初始状态开始放电。先以0.5C恒流充电到充电截止电压,再恒压充电到电流小于0.01C,认为此时的荷电状态(SOC)为100%。实验数据是取自5圈循环后的数据,因为这时电池的容量比较稳定。为了确保实验结果的准确性与可重复性,所有的实验结果取自3次重复测试的平均值。同时对电池1和电池2进行了1C 、2 C、3C放电的仿真。1C分别对应的是7.7和24.5A/m2的电流密度。其参数如表2所示。图4对正极活性物质载量为5.4mg/cm2的全电池1C、2C、3C测得的放电曲线与电池1的仿真放电曲线进行了比较。从图4(a)中可以看到,随着放电倍率的增加,电池会更快达到放电截止电压。正极活性物质载量为5.4mg/cm2的电池的3C放电容量只有其1C放电容量的94%。由于极化内阻的增加,3C放电的起始电位比1C放电的起始电位低了0.05V。而从图4(b)中可以看到,随着放电倍率的增加,仿真曲线也会更快达到放电截止电压,与实验测得的结果是类似的。对电池1而言,1C的放电容量有0.852mAh,与测得的放电容量0.884mAh极为接近。3C放电的容量相当于1C放电容量的97%,高于实际测得的结果,这可能是由于高倍率放电时极化被低估所引起的。正极活性物质载量为16.82 mg/cm2的全电池测得1C、2C、3C的放电曲线与电池2的仿真放电曲线的比较如图5所示。从图5(a)中可以看到,实验测得的3C放电的容量只有其1C放电容量的87%。除此之外,3C放电的起始电位比1C放电的起始电位低了0.09V。与正极活性物质载量为5.4mg/cm2的电池相比,随着电极厚度的增大,极化所引起的电势的下降更加明显。而对于电池2而言,1C的放电容量有2.53mAh,与测得的放电容量2.58mAh也相当接近。而且随着放电倍率的增大,仿真曲线会更快地达到放电截止电压,与实验测得的结果也是相吻合的。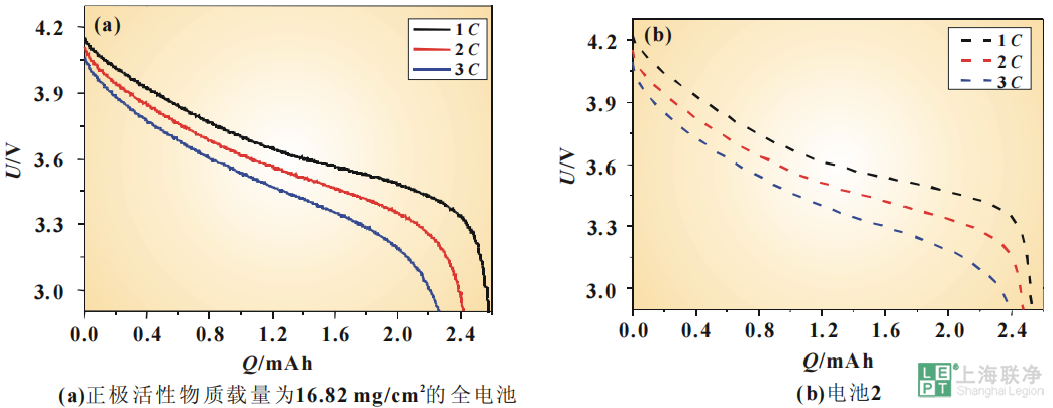 图 5 电极较厚的NCM111/石墨电池实验和仿真的放电曲线可以看到,电化学模型的仿真结果与实验测得结果具有相似的特征,电化学模型能定性地、有效地仿真NCM111/石墨电池的放电过程。锂离子电池一维电化学模型的优点在于能较准确地仿真电池的放电过程而且能较好地反映电池内部的实际情况。凭借这些信息,可以对电池的性能进行评估并对电池的设计进行优化。接下来将阐述电化学模型的部分输出结果。图6显示的是两个电池的正极区域在3C恒流放电过程中选取的不同时间点的电解质盐浓度变化过程。放电初始时刻,电池内部锂盐浓度均匀分布,随着放电过程的进行,电解质浓度迅速极化,电池内部逐渐建立起电解质浓度梯度,正极中电解质浓度逐渐降低,而隔膜中电解质浓度变化不大。在整个放电过程中,正极集流体界面一直有较高浓度的电解质,这一结果表明正极内部没有出现电解质耗竭的现象。
图 5 电极较厚的NCM111/石墨电池实验和仿真的放电曲线可以看到,电化学模型的仿真结果与实验测得结果具有相似的特征,电化学模型能定性地、有效地仿真NCM111/石墨电池的放电过程。锂离子电池一维电化学模型的优点在于能较准确地仿真电池的放电过程而且能较好地反映电池内部的实际情况。凭借这些信息,可以对电池的性能进行评估并对电池的设计进行优化。接下来将阐述电化学模型的部分输出结果。图6显示的是两个电池的正极区域在3C恒流放电过程中选取的不同时间点的电解质盐浓度变化过程。放电初始时刻,电池内部锂盐浓度均匀分布,随着放电过程的进行,电解质浓度迅速极化,电池内部逐渐建立起电解质浓度梯度,正极中电解质浓度逐渐降低,而隔膜中电解质浓度变化不大。在整个放电过程中,正极集流体界面一直有较高浓度的电解质,这一结果表明正极内部没有出现电解质耗竭的现象。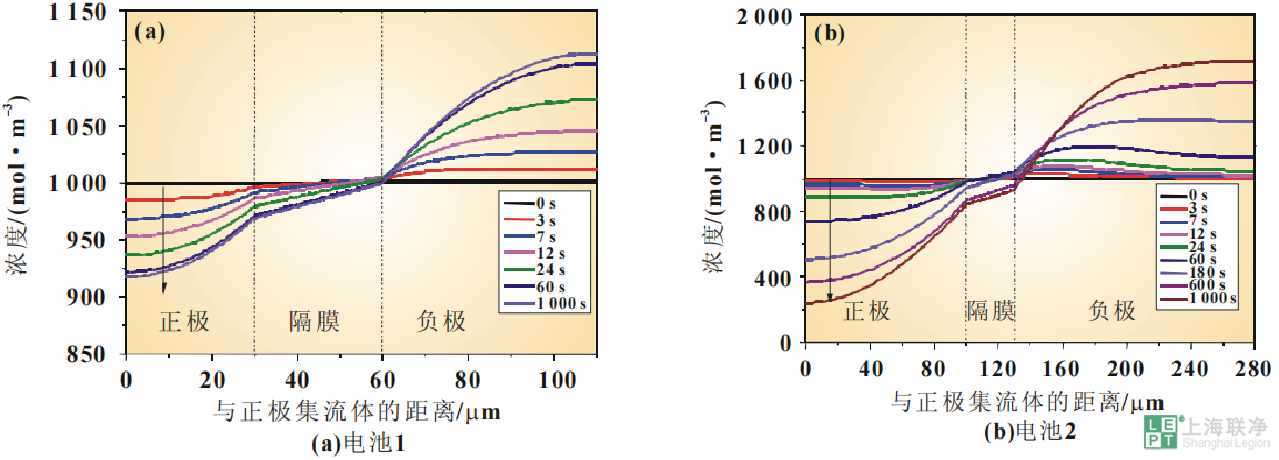
图 6 3C放电过程中电解质盐浓度的变化
但是,电池1在60s时电解质盐浓度基本上就已经形成了梯度,而电池2一直到放电末期电解质盐浓度仍在降低。另外,电池2靠近集流体一侧的电解质盐浓度比电池1的要低得多。这说明由于电极厚度的增加,电极靠近集流体侧的电解液消耗也会增加。这可能会使电化学反应速率变慢,活性物质得不到充分的利用,从而导致电池在高倍率下放电容量的降低。活性粒子表面的锂离子浓度是描述锂离子电池内部电化学反应的程度和是否平缓的重要指标。图7是电池不同放电时刻沿电极厚度方向上活性颗粒表层的Li+浓度分布曲线。由图7可知,随着放电时间的延长,正极活性颗粒表层的浓度逐渐升高。放电过程中,曲线逐渐倾斜,正极中靠近隔膜的区域内Li+浓度较高。电极越厚,曲线倾斜现象越明显。这意味着正极的锂离子浓度的分布变得更加不均匀,说明电池内部的插层反应程度不一致而且活性粒子利用的程度也不一致。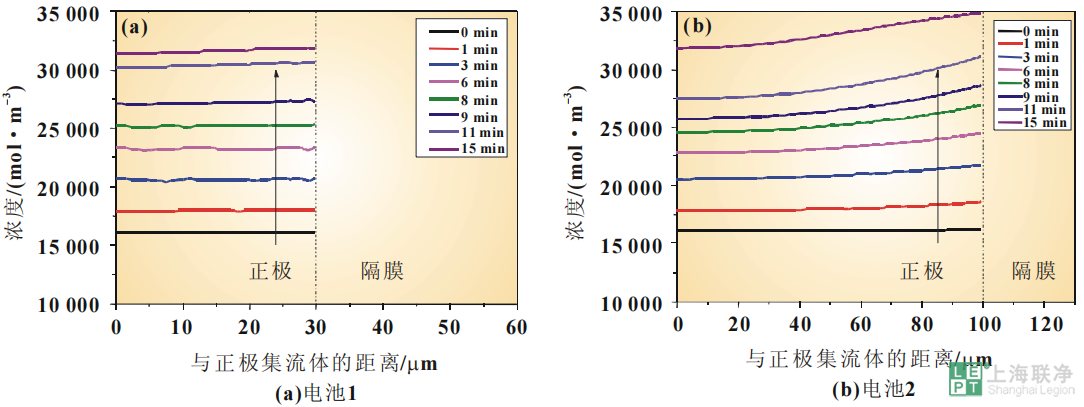
图 7 3C放电过程中活性颗粒表层锂离子浓度变化曲线
而且,因为浓差极化和扩散的限制,电池2正极内固相粒子表面的锂离子浓度分布也是不均匀的。这可能会导致电池内电化学反应速率的不一致,从而影响电池的功率输出;并导致电极内体积变化的不一致,从而导致应力积累,累积的应力可能造成电极裂缝或断裂。裂缝使活性物质孤立,从而导致电极的容量损失和阻抗增加。然而在电池1中,电极更薄,在放电过程中固相粒子表面的锂离子浓度分布在各个时间点都比较均一,这意味着电化学反应能顺畅地进行,并且确保了较高的功率和容量的输出。本文对电极厚度对过电势及电解液电势的影响也进行了研究,因为它与电池在大倍率下的放电性能息息相关。放电初始阶段和放电末期的电解液电势的差别与浓差极化有着紧密的联系,这可能会导致电池充电容量未能充分利用,而且会引起电池性能的衰减。考虑到只需比较两条曲线的差别及斜率大小,所以将电解液电势曲线进行了移动,使两条曲线的隔膜位置的电势都移动到了0V位置,如图8所示。电池1的电解液电势在整个放电阶段几乎没有变化,这意味着其浓差极化很小。
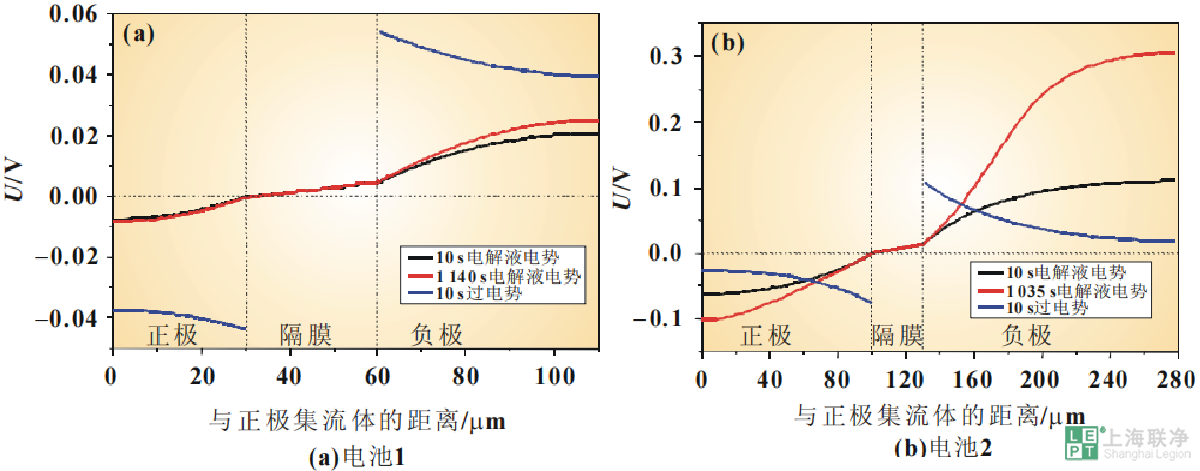
图 8 3C放电过程中过电势与电解液电势的比较
当电极变厚时,电池2中浓度梯度变大且欧姆电势降显著增加,因此由电池内电解液盐浓度分布差异造成的极化现象更为明显。对电池2的正极区域而言,电解液电势的下降由放电初始阶段的0.17V增长到放电结束时的0.41V,这是由于浓度梯度的形成及反应向电极内部的渗透。这会进一步造成放电过程中电池极化内阻的增加,削弱电池的放电能力,并且会引起更多的副反应,如电解液氧化和不可逆相变。这也是电池容量衰退的重要原因。本文制备了不同厚度的NCM111电极片,采用电化学模型对不同电极厚度的两个电池进行了仿真。将仿真结果与实验结果进行对比,验证了模型的有效性,证明基于多孔电极理论的一维锂离子电池电化学模型可以有效地仿真NCM111/石墨电池的放电过程。实验结果与仿真结果表明,电极厚度对锂离子电池电化学性能的影响是多方面的,可总结为以下三个方面:(1)尽管电极厚度的增加可以提高活性物质的比重,从而提高电池的能量密度,但会给电池的电化学性能带来负面影响。较厚的电极靠近集流体侧的电解液消耗会增加,从而增加电极的容量损失。(2)电极越厚,电极内电化学速率的差别越大。一方面,内部电化学反应越不均匀,活性物质不能充分利用,使容量降低;另一方面,有可能造成体积变化的不一致,电极内部应力累积,导致阻抗增加。(3)电极厚度的增加会导致极化内阻相应地增加,进一步削弱电池的放电能力,这也是其倍率性能较差的原因,并且有可能引起更多的副反应,导致电池容量衰退。文献参考:虢放, 薛明喆, 张存满,等. 电极厚度对锂离子电池电化学性能的影响[J]. 电源技术, 2017.
特别声明:本站所转载其他网站内容,出于传递更多信息而非盈利之目的,同时并不代表赞成其观点或证实其描述,内容仅供参考。版权归原作者所有,若有侵权,请联系我们删除。













